Il microbiota intestinale riveste una fondamentale importanza nella nostra salute, nello sviluppo del sistema immunitario, del metabolismo, persino nello sviluppo di diversi organi. Negli ultimi anni sta emergendo addirittura la presenza del cosiddetto “asse intestino-microbiota-cervello”. Con questo termine ci si riferisce ad un intricato network di connessioni biologiche che determinano una comunicazione bidirezionale tra il microbiota intestinale e il sistema nervoso del suo ospite.
Lo studio di questa importante connessione avviene al momento per lo più su modelli animali. Infatti, anche in specie diverse da quella umana, ad esempio nei topi, gran parte delle caratteristiche principali del sistema nervoso sono conservate. Inoltre, questi animali sono buoni modelli per lo studio del comportamento e delle emozioni umane. Esistono diverse vie attraverso cui il microbiota può influenzare il nostro sistema nervoso centrale e viceversa, scopriamole insieme.
Segnalazione chimica
Il microbiota intestinale può comunicare col sistema nervoso dell’ospite attraverso una segnalazione di tipo chimico, sia diretta, che indiretta.
Segnalazione diretta
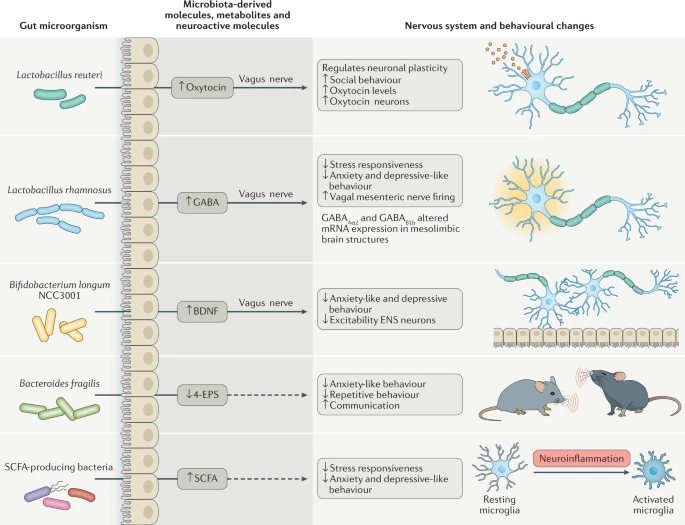
Costituiscono un esempio di segnale chimico diretto i cosiddetti Acidi Grassi a Corta Catena (SCFA), piccole molecole di natura lipidica prodotte da alcuni membri del microbiota intestinale a partire dalla degradazione di zuccheri e fibre complessi che l’ospite introduce con l’alimentazione. Questi metaboliti sono in grado di modulare la neuroplasticità, l’epigenetica e l’espressione dei geni a livello neuronale. In uno studio condotto sui topi, è stato dimostrato come viene alterata l’espressione del fattore BDNF associato alla depressione in seguito alla somministrazione massiva del sodio butirrato (uno SCFA per l’appunto).
Segnalazione indiretta
Il microbiota intestinale è in grado di influenzare il sistema nervoso centrale anche attraverso una segnalazione chimica indiretta. Tra i vari esempi, i batteri intestinali sarebbero in grado di influenzare il senso d’appetito dell’ospite agendo sulla produzione dei segnali endocrini, come il GLP1 (glucagon-like peptide), un fattore prodotto dalle cellule enteroendocrine presenti nell’epitelio intestinale in risposta ad alcuni metaboliti batterici e che modula il senso della fame. E’ stato osservato come topi che non hanno un microbiota intestinale (i cosiddetti germ-free mice) abbiano una minor produzione di GLP1 rispetto a topi con un microbiota convenzionale.
I neurotrasmettitori
Il microbiota intestinale è in grado di modulare le concentrazioni di alcuni neurotrasmettitori, principali molecole di segnalazione per il sistema nervoso. La comunità microbica intestinale riesce a produrre alcuni neurotrasmettitori impostanti, come il GABA (acido gamma-amminobutirrico) e la serotonina. Topi germ-free mostrano, per esempio, minori concentrazioni di serotonina a livello intestinale se comparati con topi con un microbiota. La serotonina prodotta a livello intestinale non è in grado di influenzare direttamente i livelli della serotonina nel cervello, poiché questa molecola non riesce a passare la barriera ematoencefalica, che regola il traffico di molecole dal sangue al cervello. Ad un’analisi più approfondita, però, si è riscontrata una minor concentrazione di serotonina nel cervello di topi germ-free rispetto a topi dotati di un microbiota intestinale. Una scoperta interessante, nonostante il collegamento diretto che spiega il ruolo giocato dal microbiota intestinale sui livelli di serotonina nel cervello, debba essere ancora individuato dai ricercatori.
Collegamento neuronale diretto
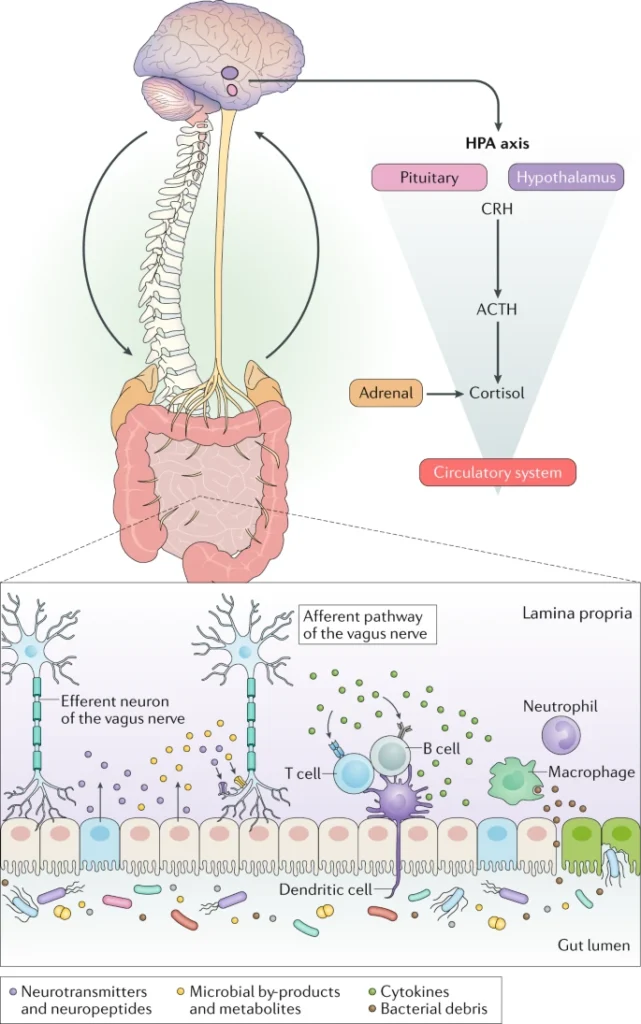
Esistono veri e propri collegamenti neuronali diretti in grado di mettere in comunicazione l’intestino (e quindi il microbiota intestinale) con il nostro sistema nervoso centrale: il sistema nervoso enterico e il nervo vago.
I topi germ-free dimostrano un minor stato di innervazione a livello dell’epitelio del colon rispetto a topi con microbiota intestinale intatto. Inoltre, metaboliti prodotti dal microbiota intestinale, come SCFA, componenti della parete batterica e molto altro, sono in grado di influenzare il sistema nervoso enterico e la motilità intestinale nei roditori. Gli effetti di queste molecole, possono poi giungere tramite pathway di segnalazione neuronale fino al sistema nervoso centrale.
Il nervo vago costituisce uno dei collegamenti più studiati tra microbiota e intestino. L’interazione microbiota-nervo vago sembra coinvolta persino nella modulazione del comportamento dell’ospite. Lo dimostrano diversi studi in cui sono stati somministrati batteri intestinali a topolini che hanno poi subito un’alterazione dell’espressione dei recettori per il GABA in regioni del cervello associate alla paura e ad altre emozioni. Tali variazioni non si riscontrano in topi vagotomizzati e trattati con lo stesso ceppo probiotico, sottolineando il ruolo giocato dal nervo vago nella risposta del sistema nervoso centrale alla somministrazione del ceppo probiotico in questione.
Segnalazione attraverso il sistema immunitario
Il sistema immunitario influenza ed è influenzato sia dal sistema nervoso centrale, sia dal microbiota intestinale. La comunità batterica intestinale sembra impattare sullo sviluppo delle microglia, cellule dell’immunità innata presenti del cervello. Topi germ-free mostrano infatti un maggior numero di microglia immature in diverse regioni del cervello rispetto a topi convenzionali. L’alterazione delle funzioni delle microglia risulta collegata con l’insorgenza di stress e fenomeni neurodegenerativi nei topi.
Anche le citochine prodotte da cellule del sistema immunitario presenti nel torrente circolatorio o prodotte direttamente nel cervello sono un mezzo di comunicazione tra microbiota e intestino. Il microbiota intestinale è in grado di influenzare la permeabilità della barriera ematoencefalica, che regola il traffico di molecole dal sangue al cervello. Un aumento della permeabilità di questa barriera, può causare un’alterata concentrazione di citochine e altri metaboliti nel cervello, situazione che potrebbe promuovere lo sviluppo di patologie neurologiche.
Si conferma ancora una volta l’importanza del microbiota intestinale e il suo coinvolgimento in importanti aspetti legati alla nostra salute.
Seppur ancora agli inizi, lo studio dell’asse intestino-microbiota-cervello si è dimostrato molto interessante per la comprensione di disturbi neurologici complessi e per lo sviluppo di nuovi approcci terapeutici.
Referenze
Morais, Livia H et al. “The gut microbiota-brain axis in behaviour and brain disorders.” Nature reviews. Microbiology vol. 19,4 (2021): 241-255. doi:10.1038/s41579-020-00460-0 https://www.nature.com/articles/s41579-020-00460-0

Lascia un commento